- ?Чжуншэнь? — 20 лет в сфере ВЭД.
- Телефон: +86 139 1787 2118
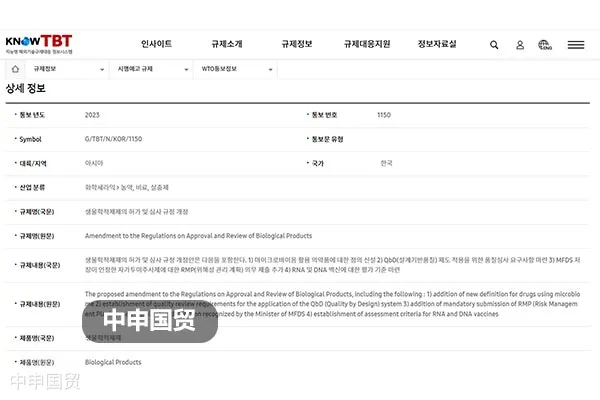
26 июня 2023 года Министерство пищевой безопасности и медико-фармацевтической продукции (MFDS) Южной Кореи представило уведомление No G/TBT/N/KOR/1150 в Всемирную торговую организацию (ВТО), планируя внести изменения в "Положения о лицензировании и экспертизе биологических препаратов и других видов препаратов". Цель внесения изменений заключается в дальнейшем усилении безопасности биологических препаратов на внутреннем рынке. По состоянию на 25 августа 2023 года эта ревизия находится на стадии сбора мнений.
Наша страна является вторым по величине рынком биологических препаратов в мире, и масштабы экспорта соответствующих продуктов ежегодно увеличиваются. Только в 2022 году объем экспорта китайских медицинских продуктов в Южную Корею достиг 1,257 млрд долларов США. В настоящее время Южная Корея является крупнейшим страной-импортером ?западных лекарственных препаратов? из нашей страны, поэтому данное пересмотрение имеет большое влияние на экспортные предприятия нашей страны. Рекомендуется, чтобы экспортные предприятия должны пристально следить за изменениями в содержании данного пересмотрения, своевременно корректировать стратегии продукции и избежать ненужных торговых потерь в будущем экспорте.
Обзор внесенных изменений:
(1) Определение новых значений слов: определение новых терминов, таких как препараты живых бактерий и т. д.;
(2) Требования к аудиту системы качества: разработаны требования к аудиту качества, применимые к концепции проектирования системы качества (QbD) (пункты 4 и 26 плана).
(3) Расширение области ?Индекса цитирования научных работ?: была расширенная область ?Индекса цитирования научных работ?, которая признается как информация о фармакологическом действии и эффекте клинических испытаний (пункт 7 плана).
(4) Улучшение условий представления материалов о испытаниях на стабильность: при изменении метода производства были внесены изменения в условия представления материалов о испытаниях на стабильность.
(5) Процедура представления плана управления рисками: Для самопроводимых препаратов для инъекций, одобренных MFDS, была введена процедура обязательного представления плана управления рисками (RMP).
(6) Критерии оценки РНК- и ДНК-вакцин: Были установлены критерии оценки РНК- и ДНК-вакцин.
Рекомендуем также:
? 2025. Все права защищены. Шанхайская ICP-лицензия № 2023007705-2  Номер разрешения на безопасность в сети Шанхая: 31011502009912.
Номер разрешения на безопасность в сети Шанхая: 31011502009912.