- ?Чжуншэнь? — 20 лет в сфере ВЭД.
- Телефон: +86 139 1787 2118
В последние несколько лет в БразилииМедтехникаПромышленность непрерывно развивается и стала крупнейшим рынком медицинского оборудования в Латинской Америке. Для экспортеров крайне важно ознакомиться с правилами допуска медицинского оборудования в Бразилию. В данной статье проводится глубокий анализ законодательных органов Бразилии по медицинскому оборудованию, классификации медицинского оборудования, а также маркетингового доступа продукции медицинского оборудования и других аспектов.
Содержание
ToggleЗаконодательство и регулирующие органы медицинского оборудования в Бразилии
Основным регулирующим документом в области медицинского оборудования в Бразилии является RDC185/01. Этот регламент осуществляет Национальное управление санитарного надзора (ANVISA). ANVISA — основной регулирующий орган Бразилии, отвечающий за одобрение и контроль за доступом медицинских изделий на рынок.
Классификация медицинских изделий Бразилии
В Бразилии медицинские изделия классифицируются по уровню риска на четыре категории: I, II, III и IV. Категория I соответствует минимальному риску, а категория IV — максимальному риску. Правила классификации медицинских изделий подробно изложены в приложении II к регламенту RDC 185.
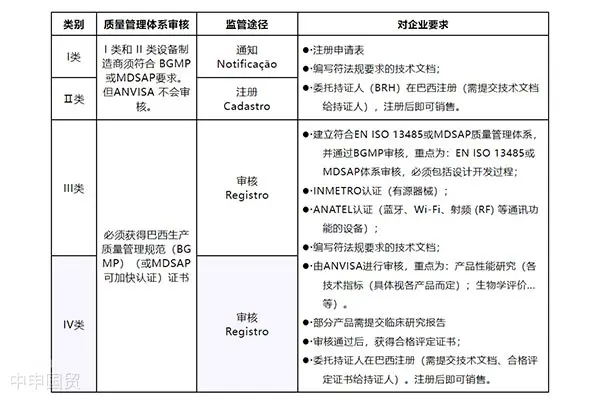
Маркетинговое прохождение медицинских изделий в Бразилии
Бразилия в отношении любых продуктов, связанных с человеком (включая лекарственные препараты, медицинское оборудование, косметикуКосметикаи т.д.) регулируются строго. Перед продажей этих продуктов экспортеры должны подать письменное заявление в Министерство здравоохранения Бразилии и предоставить регистрационные документы через официально назначенного держателя регистрации. Эти документы должны быть преимущественно на португальском языке.
Медицинские изделия с источником питания должны пройти сертификацию. Процесс сертификации проводится независимой третьей стороной, которая проводит испытания продукции и аудит производственного завода. Для медицинских изделий высокого риска III и IV классов производители могут выбрать аудит в рамках MDSAP (Медицинская программа единообразного аудита) вместо аудита ANVISA. Стоит отметить, что в Бразилии в настоящее время опубликован список из 11 аккредитованных лабораторий для проведения испытаний в рамках MDSAP.
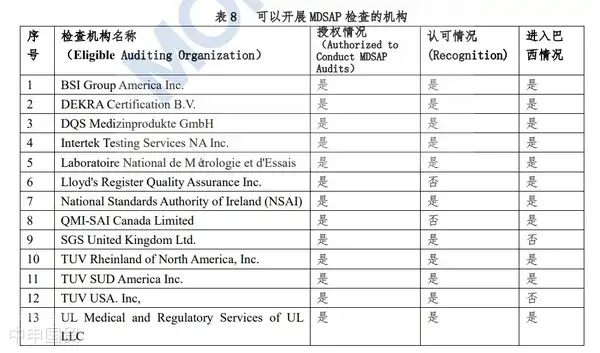
(1) Что такое MDSAP
MDSAP — это сокращение от Medical Device Single Audit Program (единая программа аудита медицинского оборудования), которая была запущена комитетом регулирующих органов MDSAP Международного форума регулирующих органов медицинского оборудования (IMDRF). MDSAP, также известная как совместный аудит пяти стран, представляет собой новую программу аудита, признанную и присоединенную регулирующими органами пяти стран: США (FDA), Австралии (TGA), Бразилии (ANVISA), Канады (HC) и Японии (MHLW).
(2)Процесс регистрации ANVISA
Для иностранных производителей, которые хотят продавать медицинское оборудование на бразильском рынке, необходимо пройти сертификацию и регистрацию в соответствии с требованиями ANVISA. Основные шаги и процесс включают определение категории продукта, назначение бразильского регистрационного держателя (BRH), прохождение сертификации INMETRO, проверку производства на соответствие BGMP, подготовку технической документации, оплату заявленных расходов и окончательное получение разрешения на продажу.
(3)Основные регулименты, применимые к разрешению на поставку медицинского оборудования, экспортируемого из Бразилии
В Бразилии для получения разрешения на размещение медицинских изделий на рынке необходимо соблюдать ряд основных регулирующих актов, включая регулименты по допуску медицинских изделий RDC 185/2001 и RDC 40/2015, а также регулименты по клиническим испытаниям RDC 10/2015 и регулименты по стандартам хорошего производственного практики (GMP) для производителей медицинских изделий RDC 183/2017.
Бразильский рынок медицинского оборудования, несмотря на свою огромность, характеризуется относительно сложными регулировками для входа на рынок. Для экспортеров, желающих продавать свои продукты на бразильском рынке, очень важно понять и соблюдать эти правила. Это не только гарантирует легальное введение их продукции на рынок, но и помогает сократить возможные юридические риски и ненужные издержки.
Рекомендуем также:
? 2025. All Rights Reserved. 滬ICP備2023007705號-2  Номер разрешения на безопасность в сети Шанхая: 31011502009912.
Номер разрешения на безопасность в сети Шанхая: 31011502009912.










